 作者
作者  通讯作者
通讯作者
《分子植物育种》网络版, 2012 年, 第 10 卷, 第 66 篇 doi: 10.5376/mpb.cn.2012.10.0066
收稿日期: 2012年06月29日 接受日期: 2012年07月11日 发表日期: 2012年12月18日
棉花的体细胞胚胎发生严重依赖于其基因型,这大大限制了细胞融合与基因工程在棉花遗传改良上的应用。为了拓展棉花体胚发生的基因型来源,本实验选择不同基因型的优异棉花品种(系)为材料,利用MSB基本培养基筛选高频体细胞胚胎发生棉花材料。结果表明,在添加2,4-D (0.1 mg/L)和KT (0.1 mg/L)的MSB培养基上所有材料都能诱导出愈伤组织,但继代3~4次后仅有大铃棉和邯8959两个材料能分化出胚性愈伤组织。在添加IBA (0.5 mg/L)和KT (0.15 mg/L)的MSB培养基上能,大铃棉和邯8959的胚性愈伤能够高频萌发形成胚状体,每克胚性愈伤组织能形成10~25个胚状体,并再生出完整植株。本研究筛选出的优异棉花种质材料大铃棉和邯8959为棉花基因工程开拓了新的种质资源。
转基因棉花在中国的研究已经取得了巨大的成绩,转基因棉花(如抗虫, 抗除草剂)的应用也得到普遍推广,一些其他性状的转基因棉花(如抗病, 抗逆, 纤维品质等)也陆续被报道(Wu et al., 2004; He et al., 2005; 赵福永等, 2005)。棉花基因工程的应用正是取得这些成绩的有效手段。目前,棉花的遗传转化大多借助于农杆菌介导进行,这就必需通过棉花组织培养和体细胞胚胎发生才能获得转基因植株。虽然棉花组织培养和体细胞胚胎发生经过30多年的发展与改良,仍然仅有少数棉花材料能够通过组织培养和体细胞胚胎发生获得再生植株。因此,棉花组织培养和体细胞胚胎发生体系中存在的严重基因型限制(顾冉冉等, 2010)。基因型限制主要表现在棉花品种间体细胞胚胎发生和植株再生能力存在着差异,目前仅珂字棉系列、中棉所系列、鲁棉系列等少数品种获得了体细胞胚和再生植株(谢德意等, 2007)。目前我国生产上种植的棉花品种超过200个,但其中绝大多数品种难以形成体细胞胚胎,这严重限制了棉花遗传转化与改良。此外,在棉花分子生物学研究中,除了分离与克隆目标基因、构建高效表达载体等技术外,选择适当的受体材料以及建立其相应的组织培养和高效的遗传转化与再生体系也至关重要(罗晓丽等, 2011)。因此,利用现代生物技术的手段来改良棉花的抗逆性和丰产性以及创新棉花种质资源,必须筛选具有高频体细胞胚胎发生及再生能力的优异棉花种质材料,尤其要适用于大田生产上广泛使用的优异棉花材料。本研究旨在筛选我国优异棉花种质材料的体细胞胚胎发生及植株再生材料,以加快棉花转基因育种和基因功能分析、转基因棉花产业化推广的进程。
1结果与分析
1.1棉花愈伤组织诱导与继代
以棉花下胚轴切段为外植体诱导愈伤组织,所用培养基为诱导培养基(即MSB2)。经过7 d左右的诱导,外植体的两端膨大,形成少量的愈伤组织(如图1)。在培养30 d后,10个供试棉花材料均能形成愈伤组织,而且愈伤的量比较多。但这些棉花材料的愈伤组织诱导率不尽相同,大铃棉和邯8 959愈伤组织诱导率可以达到100%。所有供试棉花材料诱导的愈伤组织的颜色、质地不尽相同,详见表1。
|
|
|
|
1.2愈伤组织的分化与植株再生
将诱导出的新鲜愈伤组织继代到愈伤增值培养基(MSB3)上进行连续继代培养,并对愈伤组织的生长速度进行了观察。取每个供试棉花材料的愈伤组织1 g左右接种到MSB3培养基上,7 d后称量其增重,结果如图2。
|
|
从图2并结合表1可以看出,大铃棉和邯8959两个棉花材料的愈伤组织生长速度相对较慢,而且其生长状态比较疏松、颜色淡黄,与其他能够通过体细胞胚胎发生途径再生的棉花品种(系)一致(罗晓丽等, 2011)。
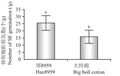
在MSB3培养基上经过4个月的连续继代培养,10个供试的优异棉花材料仅有大铃棉和邯8959的愈伤组织分化出淡黄色、米粒状的胚性愈伤组织(图3A)。将这两个供试材料的新鲜胚性愈伤组织转移到愈伤组织分化培养基(MSB4)上,经过1~2次继代培养胚性愈伤组织顺利萌发,但大铃棉和邯8 959的胚性愈伤组织的萌发率却存在差别(萌发率为3周内单位重量的胚性愈伤组织(g)萌发形成的胚状体数(个)) (图4),邯8 959的胚性愈伤组织萌发能力强于大铃棉,但两者都能最终形成子叶胚(图3B)。
|
|
|
|
将完全成熟的子叶胚转移到成苗再生培养基(MSB5)上,子叶胚(图5A)逐渐发育再生成完整植株(如图5B)。
|
|
2讨论
通过体细胞胚胎发生是进行棉花农杆菌介导的遗传转化最好的途径,但建立棉花体细胞胚胎发生途径的再生体系却非常困难。在棉花体细胞胚胎发生过程中,培养基成分、激素、外植体材料等都影响着棉花愈伤组织的诱导与胚状体的形成。但是外植体的基因型是这些限制因子中的最重要因素之一,针对此问题本课题选择生产上具有优异性状的棉花品种(系)来筛选高体胚发生能力的种质材料。这些材料具有广泛的优异性状,包括大铃、长绒、高比强、耐黄萎病、高油份以及综合性状较好的棉花材料。在添加2,4-D (0.1 mg/L)和KT (0.1 mg/L)的MSB培养基上所有材料都能诱导出愈伤组织,这与前人的研究基本一致(Zhang et al., 2000),即2,4-D是诱导棉花体细胞胚胎发生的重要激素。
在棉花体细胞胚胎发生过程中,经过外植体初期诱导分化形成的非胚性愈伤组织转化为胚性愈伤组织是最为关键的。在本研究中,采用通用的培养基(2,4-D和KT组合)在不进行其它调控的基础上,经过3~4次的继代培养大铃棉和邯8959能够分化形成胚性愈伤组织。这与目前应用较多的YZ1体细胞胚胎发生时间基本相似(朱华国等, 2012),但是大铃棉和邯8959分别具有大铃和长绒、高比强等优异性状。因此,在实际生产应用上大铃棉和邯8959明显优于棉花品系YZ1,同时也扩大了通过体细胞胚胎发生途径再生的棉花基因型来源。
3材料与方法
3.1材料
10个优异棉花品种(系) (表2),由中国农科院棉花研究所提供,这个10个棉花品种(系)在生产上具有不同的优异性状。
|
|
3.2棉花无菌苗的获得
种子经脱壳后,用0.1% (W/V) HgCl2溶液中消毒8 min,用无菌水冲洗3~4次,然后接种于无菌苗培养基(MSB1)上,于(28±1)℃下暗培养5~7 d左右得到无菌苗。
3.3棉花愈伤诱导和培养
将棉花无菌苗下胚轴分别切成0.5 cm左右的小段,平放于诱导愈伤组织的培养基(MSB2)上,每个材料接种10瓶(每瓶10个外植体),30 d后统计愈伤组织诱导率(诱导出愈伤组织的外植体数/接种的总外植体数),并将愈伤组织转移到愈伤增殖培养基上(MSB3),每3~4周继代1次,并计算愈伤增殖率(一定时间内单位重量的愈伤组织增长量,本实验中以1 g愈伤在7 d内的增长计算),直至愈伤组织分化为颜色淡黄、松散细小颗粒状的胚性愈伤组织。
3.4棉花胚性愈伤组织的继代和萌发再生
将颜色淡黄松散细小颗粒状的、分化的胚性愈伤组织转入MSB4培养基上,每3~4周继代1次,至胚性愈伤萌发并出现完整的体细胞胚胎(子叶胚)。将完全萌发的胚状体(子叶胚)转到再生培养基上(MSB5),对这些体细胞胚继续培养直至获得再生小苗。
本实验中所有培养基成分组成列于表3。所用培养基添加0.5% (W/V)的琼脂粉,pH均为5.8,并以121℃高温、高压灭菌12 min。培养温度为(28±1)℃,每天光培养14 h,暗培养10 h。
|
|
作者贡献
李雪林、王翠玲和孟超敏是本研究的实验设计和实验研究的执行人;李雪林完成数据分析;王翠玲参与实验设计,试验结果分析;孟超敏是项目的构思者和负责人,指导实验设计,数据分析,论文写作与修改;全体作者都阅读并同意最终的文本。
致谢
本研究由河南科技大学博士启动基金(09001463)和河南科技大学青年科学基金(2011QN038)共同资助。感谢河南科技大学农学院的熊晨琳、赵倩同学在本实验过程中提供的帮助。
参考文献
Gu R.R., Xue J.J., Yuan Y.G., Peng M., and Cui B.M., 2010, High efficiency of somatic embryogenesis and plant regene- rati on from cotton (Gossypium hirsutum L.), Shengwu Jishu Tongbao (Biotechnology Bulletin), (8): 145-149 (顾冉冉, 薛金教, 袁英歌, 彭明, 崔百明, 2010, 棉花高频体细胞胚胎发生及再生体系建立, 生物技术通报, (8): 145-149)
He C.X., Yan J.Q., Shen G.X., Fu L.X., Holaday A.S., Auld D., Blumwald E., and Zhang H., 2005, Expression of an Arabi- dopsis vacuolar sodium/proton antiporter gene in cotton improves photosynthetic performance under salt conditions and increases fiber yield in the field, Plant Cell Physiol., 46(11): 1848-1854
http://dx.doi.org/10.1093/pcp/pci201
PMid:16179357
Luo X.L., Jiang Y.L., Xiao J.L., Wu Z.X., Zhang A.H., Wang Z.A., and Wu J.H., 2011, Establishment of somatic embryogenesis and plant regeneration system of early mature cotton varieties, Xibei Zhiwu Xuebao (Acta Botanica Boreali- Occidentalia Sinica), 31(3): 609-615 (罗晓丽, 姜艳丽, 肖娟丽, 武宗信, 张安红, 王志安, 吴家和, 2011, 早熟棉体细胞胚胎发生和植株再生体系的建立, 西北植物学报, 31(3): 609-615)
Wu C.A., Yang G.D., Meng Q.W., and Zheng C.C., 2004, The cotton GhNHX1 gene encoding a novel putative tonoplast Na+/H+ antiporter plays an important role in salt stress, Plant Cell Physiol., 45(5): 600-607
http://dx.doi.org/10.1093/pcp/pch071
PMid:15169942
Xie D.Y., Jin S.X., Guo X.P., and Zhang X.L., 2007, Somatic embryogenesis and plant regeneration in cotton cultivars from Yellow and Yangtze river planting areas, Zuowu Xuebao (Acta Agronomica Sinica), 33(3): 394-400 (谢德意, 金双侠, 郭小平, 张献龙, 2007, 长江和黄河流域棉区棉花品种体细胞胚胎发生和植株再生比较研究, 作物学报, 33(3): 394-400)
Zhang B.H., Liu F., and Yao C.B., 2000, Plant regeneration via somatic embryo-genesis in cotton, Plant Cell Tiss. Org., 60: 89-94
Zhao F.Y., Xie L.X., Tian Y.C., and Xu P.L., 2005, Glyphosate- resistant and bollworm-resistant transgenic cotton plants with the aroAM12 and Bts1m genes, Zuowu Xuebao (Acta Agronomica Sinica), 31(1): 108-113 (赵福永, 谢龙旭, 田颖川, 徐培林, 2005, 抗草甘膦基因aroAM12及抗虫基因Btslm的转基因棉株, 作物学报, 31(1): 108-113)
Zhu H.G., Zhang X.L., Jin S.X., and Liu G.Z., 2012, Histological observation of the processes during somatic embryogenesis in the two most commonly used PGR regimes in cotton, Mianhua Xuebao (Cotton Science), 24(2): 159-166 (朱华国, 张献龙, 金双侠, 刘冠泽, 2012, 两种常用激素组合下棉花体细胞胚胎发生过程的组织学观察, 棉花学报, 24(2): 159-166)
.png)
.png)
.png)
.png)

.png)
.png)